
想象你站在化学世界的十字路口,面前是无数种化合物,其中盐类就像是一群性格迥异的居民,它们有的喜欢热闹,在水中自由自在;有的则害羞,几乎不与水为伍。今天,就让我们一起探索盐类的溶解性,揭开它们背后的秘密。 盐,这个看似普通的名词,却蕴含着丰富的化学知识。从我们日常生活中的食盐,到实验室中的各种盐类,它们的溶解性各不相同,这背后究竟隐藏着怎样的规律呢?让我们从多个角度出发,深入解析盐类的溶解性。 在盐类的大家庭中,钾钠铵盐和硝酸盐无疑是那群最活跃的成员。它们在水中几乎都能溶解,就像是一群狂欢者,在水中自由自在地舞动。钾钠铵盐之所以易溶于水,是因为它们的离子半径较小,与水分子之间的相互作用力较强,从而容易在水中形成水合离子。而硝酸盐则因为硝酸根离子的电负性较高,与水分子之间的氢键作用力较强,也容易溶解于水。 盐酸盐,也就是氯化物,在盐类的溶解性中显得有些特别。它们大多数都能溶于水,但氯化银和氯化亚汞却是个例外,它们就像是一群害羞的舞者,不愿意在水中过多地展现自己。这是因为氯化银和氯化亚汞的晶格能较高,需要更多的能量才能打破其晶格结构,从而在水中溶解。 硫酸盐在盐类的溶解性中是一个性格多变的家族。大多数硫酸盐都能溶于水,但硫酸钡和硫酸铅却是个例外,它们就像是一群性格内向的成员,不愿意与水为伍。这是因为硫酸钡和硫酸铅的晶格能较高,而且它们的离子半径较大,与水分子之间的相互作用力较弱,从而难以在水中溶解。 碳酸盐在盐类的溶解性中是一个选择性溶的家族。它们大多数不溶于水,但钾、钠、铵盐却是个例外,它们就像是一群喜欢挑战的成员,愿意与水进行互动。这是因为钾、钠、铵盐的离子半径较小,与水分子之间的相互作用力较强,从而容易在水中形成水合离子。而其他碳酸盐则因为它们的离子半径较大,与水分子之间的相互作用力较弱,从而难以在水中溶解。 在盐类的溶解性中,碱类是一个少数派的代表。它们大多数不溶于水,但氢氧化钾、氢氧化钠、氢氧化钡和氨水却是个例外,它们就像是一群勇敢的探索者,愿意与水进行互动。这是因为碱类的离子半径较大,与水分子之间的相互作用力较强,从而容易在水中形成水合离子。而其他碱类则因为它们的离子半径较小,与水分子之间的相互作用力较弱,从而难以在水中溶解。 多硫化物在盐类的溶解性中是一个研究的焦点。它们在水中和有机溶剂中的溶解度都较大,这主要是因为多硫化物的阴离子具有较大的极性,与水分子和有机溶剂分子之间的相互作用力较强。多硫化物的溶解性在钠硫电池、锂硫电池等领域有着重要的应用前景。 盐类的溶解性受到多种因素的影响,包括离子半径、晶格能、水合能等。离子半径较小的盐类通常具有较高的溶解度,因为它们更容易与水分子形成水合离子。晶格能较高的盐类通常具有较高的溶解度,因为它们需要更多的能量才能打破其晶格结构。水合能较高的盐类通常具有较高的溶解度,因为它们更容易与水分子形成水合离子。 盐类的溶解性在化学、生物、医药等领域有着广泛的应用。例如,在化学中,盐类的溶解性可以用来制备各种溶液和沉淀;在生物中,盐类的溶解性可以用来维持细胞内外液的渗透压;在医药中,盐类的溶解性可以用来制备各种药物和注射液。 盐类的溶解性是一个复杂而有趣的话题,它涉及到多种化学原理和现象。通过深入解析盐类的溶解性,我们可以更好地理解化合物的性质和 behavior,从而更好地应用它们于实际生活中。让我们一起继续探索化学世界的奥秘,发现更多有趣的现象和规律。 探索盐类的溶解性
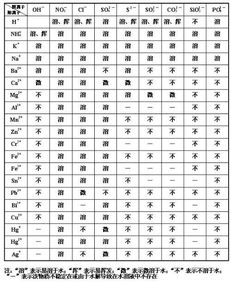
钾钠铵盐和硝酸盐:水中的狂欢者
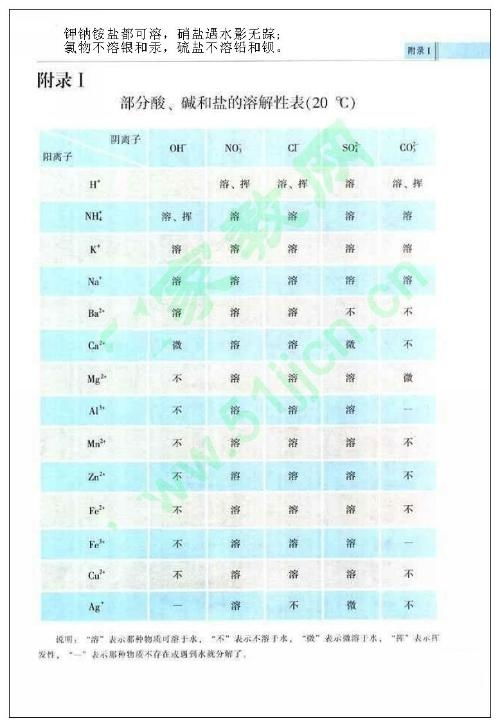
盐酸盐:害羞的舞者
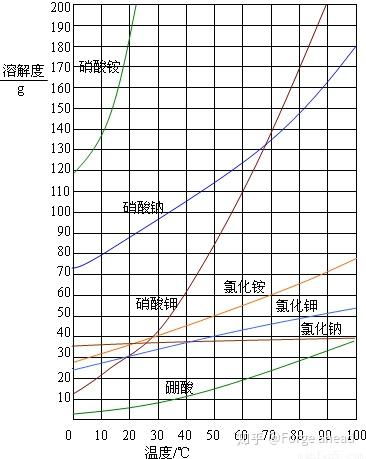
硫酸盐:性格多变的家族
碳酸盐:选择性溶的家族
碱类:少数派的代表
多硫化物:溶解性研究的焦点
盐类溶解性的影响因素
盐类溶解性的应用